全球首例基因编辑猪肺人体移植成功:功能维持9天的医学里程碑
- 科技资讯
- 2025-12-26
- 356
中国科研团队实现了世界首次将经过基因编辑的猪肺移植到人类体内的重大医学突破。
由广州医科大学附属第一医院何建行教授领衔的研究小组,将一只经过基因修饰的巴马香猪左肺植入一名脑死亡者体内,术后移植肺维持通气与气体交换功能长达9天。
该研究成果已于8月25日发表于国际权威学术期刊《自然-医学》。
国际专家对此项成果给予高度评价,认为这是相关研究领域的“一个里程碑式进展”。
该成就凸显了通过基因编辑技术使猪器官与人体更兼容的潜力,有望助力缓解肺移植供体短缺这一全球性难题。
基因编辑猪肺移植
研究团队指出,尽管受试者出现了免疫反应和一定程度的器官损伤,但并未立即产生对基因编辑猪肺的强烈排斥。
这项研究标志着异种移植领域的关键进展,即实现不同物种间的器官交换实践。
当前全球器官移植需求持续增长,异种器官移植被视为解决供体短缺困境的有力途径。
据相关报道,过去30年中,猪心瓣膜已广泛用于人类移植手术,而整个器官移植则更为复杂。医学界在基因编辑猪心脏和猪肾脏移植方面已取得部分成功,并尝试过基因编辑猪肝脏移植,但迄今效果有限。
西班牙国家移植组织主任比阿特丽斯·多明格斯-希尔表示:“以往的异种器官移植试验主要集中在肾脏、心脏和肝脏。相比之下,异种肺移植面临更严峻的挑战。”
由于肺部生理平衡极为微妙,它接收大量血流,并持续暴露于外界空气中,因此特别容易受到损伤。
肺脏在血液过滤、体温调节、血小板生成、pH平衡和免疫防御中扮演关键角色,同时具备代谢和内分泌功能。与肾脏或心脏不同,肺部在呼吸过程中会接触空气中的病毒和细菌等外部因素。
基于这些原因,即便是人类之间的肺移植也公认极具难度。
广州医科大学附属第一医院团队将基因编辑的猪肺成功移植至人体,被业界专家视为异种移植这一长期探索领域的重要一步。接受移植的是一名39岁脑死亡男性,移植器官存活了9天。
在第9天结束时,猪肺被取出以供分析,而该男子根据家属意愿撤除了生命支持系统。
研究团队表示,未来将进一步优化基因编辑策略和抗排异治疗方案,以延长移植器官的存活及功能维持时间,并将团队自主研发的无管技术应用于异种肺移植试验,减少机械通气对供体肺的损伤,推动异种肺移植向临床转化。
器官功能维持9天
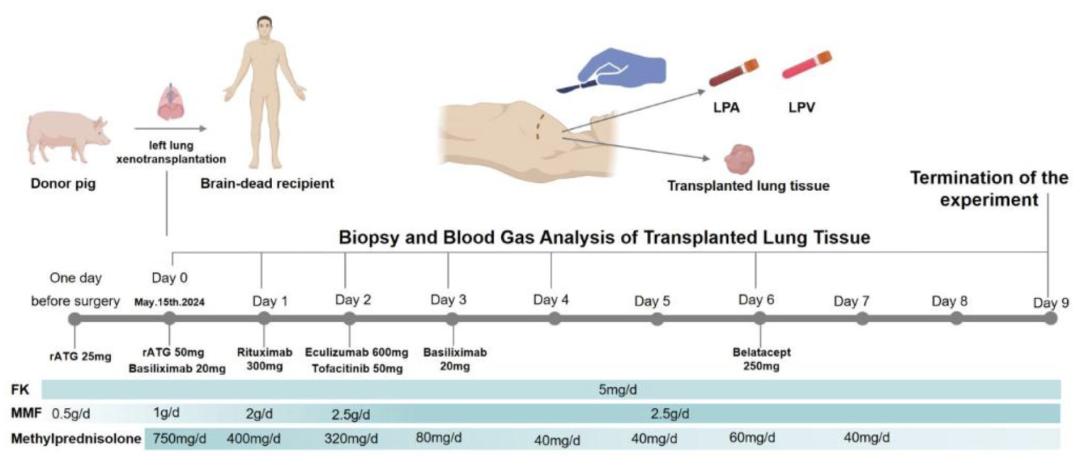
供体猪肺进行了六处CRISPR基因编辑——敲除了三个编码免疫系统触发糖的基因(这些糖存在于猪细胞表面),并加入了三个调节炎症及其他免疫反应的人类蛋白基因,以降低移植到人体后的免疫风险。
受试者同时接受了多种药物以降低感染和排斥风险。
研究团队用供体猪肺替换了受试者的左肺。该肺在新环境中正常运作,为患者血液提供氧气并清除二氧化碳。
通过多重基因编辑,移植肺成功避免了异种器官移植中常见的超急性排斥反应——这种针对外来器官的即时免疫应答会导致血管坏死及器官衰竭,即便是同种移植也常在数小时内失败。
但在移植24小时后,研究人员观察到受试者体内开始产生促炎分子,白细胞逐渐浸润猪肺组织。
胸部扫描显示新器官出现积液——这是组织损伤的迹象,可能由缺血再灌注损伤引发。
术后第3天和第6天,抗体介导的排斥反应似乎对移植器官造成了损害。
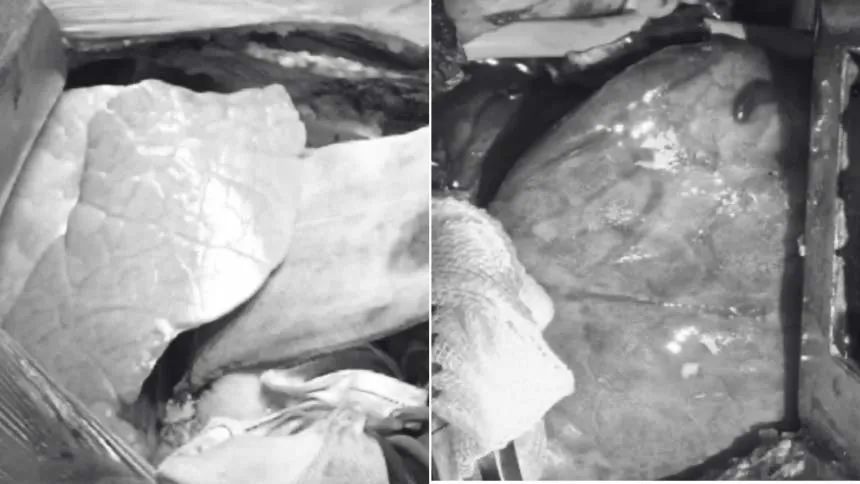
上图展示了移植后的猪肺以及四天后的情况
第9天,实验在家属要求下结束。
记录表明,在216小时的监测期内,移植器官保持了活力与功能,期间未发生超急性排斥反应,同步病原学监测也未发现活跃感染迹象。
免疫抑制治疗方案包括兔抗胸腺球蛋白、巴利昔单抗、利妥昔单抗、依库珠单抗、托法替布、他克莫司、霉酚酸酯以及逐步减量的糖皮质激素,术后根据免疫状态评估进行调整。
仍需进一步研究
将动物器官移植给人类的异种器官移植是当今全球医学研究的前沿热点。
这项工作被马萨诸塞总医院(MGH,美国乃至世界顶尖医院之一)的外科医生理查德·皮尔逊三世称为“首次观察猪肺移植到人类体内的过程,令人振奋”,他已进行数十次将猪肺移植给狒狒以测试异种肺移植策略。
皮尔森提及,在其团队实验中,体内植入猪肺的黑猩猩最长存活了34天。
在伦理和安全方面,广州医科大学附属第一医院的研究方案严格遵循国家法律法规和伦理规范,先后通过医院伦理委员会等机构的审查与监督。
受试者因重型颅脑损伤,经四次独立评估确认脑死亡。其家属出于支持医学进步的意愿,同意无偿参与研究。
纽约大学朗恩医疗中心心脏和肺移植专家贾斯汀·钱表示,利用脑死亡者测试这些器官是该项高风险研究在伦理和安全方面的重要步骤。
他将此项新工作描述为“该领域逐步推进所必需的基础。”
此外,为延长实验时间并获取更多关于免疫排斥及其他问题的信息,研究人员仅移植了一侧猪肺,保留了患者另一侧肺脏以辅助呼吸;而接受人类肺移植的患者通常需替换双侧肺脏。
研究人员强调:“尽管这项研究证实了猪肺移植到人体的可行性,但器官排斥和感染等相关挑战依然存在,在该程序转化为临床应用前,仍需进行更多临床前研究。”
参考链接
[1]https://www.nature.com/articles/s41591-025-03861-x
[2]https://www.news.cn/tech/20250825/09b7951fd9a04e2db5234eddf23fbb0e/c.html
[3]https://www.science.org/content/article/first-pig-lung-survives-and-functions-briefly-person
[4]https://www.statnews.com/2025/08/25/first-lung-xenotransplant-gene-edited-pig/
[5]https://www.nationalgeographic.com/science/article/first-pig-to-human-lung-transplant-china
本文由主机测评网于2025-12-26发表在主机测评网_免费VPS_免费云服务器_免费独立服务器,如有疑问,请联系我们。
本文链接:https://www.vpshk.cn/20251212813.html